APSB | 通过表观遗传疗法重塑“冷”肿瘤免疫微环境,克服免疫治疗难题
发布时间:2022-09-17
过去十年来,PD-1/PD-L1免疫疗法几乎应用到了所有类型癌症的临床试验,开辟了肿瘤免疫治疗的新时代。然而对于许多肿瘤类型而言,免疫检查点阻断剂的单药治疗效果不佳。究其原因,T细胞首先需要被激活并迁移到肿瘤部位并浸润到肿瘤内部才能发挥PD-1/PD-L1阻断剂的作用,恢复对肿瘤细胞的杀伤作用。但是有的肿瘤内部及微环境的T细胞浸润少,导致这类肿瘤对PD-1/PD-L1免疫疗法响应率低,故被称为“冷”肿瘤。由低免疫原性的“冷”肿瘤到高免疫原性的“热”肿瘤的转化受到肿瘤免疫和代谢的双重调控。因此,寻找能同时调控肿瘤免疫和肿瘤代谢的治疗策略,化“冷”为“热”,是提高PD-1/PD-L1免疫治疗效果的关键所在。
近日,中科中山药物创新研究院黄永焯课题组在药学领域著名学术期刊《药学学报》英文版《Acta Pharmaceutica Sinica B》(IF:14.903,JCR一区)发表了题为“Remodeling “cold” tumor immune microenvironment via epigenetic-based therapy using targeted liposomes with in situ formed albumin corona”的研究成果。在该研究中,黄永焯团队构建了可同时靶向肿瘤细胞和巨噬细胞的脂质体递送载体,并结合表观遗传药物联合治疗策略,在“冷”肿瘤结直肠癌的免疫治疗方面取得进展。
结直肠癌是一种典型的免疫“冷”肿瘤,只有约15%的病人属于免疫敏感型,药物免疫疗效很有限。针对于此,本项研究采用Pano(帕比司他,可激活T细胞并调节肿瘤代谢)与JQ1(PD-L1阻断剂)两种表观遗传药物的联合治疗策略,通过Pano促进T细胞浸润到肿瘤内,重塑结直肠癌细胞免疫微环境和代谢微环境,达到“双管齐下”的效果。此外,该研究构建了乳铁蛋白修饰、白蛋白原位吸附的靶向脂质体递药体系,可同时靶向肿瘤细胞和巨噬细胞,实现药物Pano和JQ1的高效递送,实现化“冷”为“热”,提高PD-L1阻断剂的免疫疗效。
本项研究为克服免疫“冷”肿瘤的治疗困境提供了一种新的联合治疗思路。中山药创院药物制剂研究中心黄永焯研究员为该论文的通讯作者。
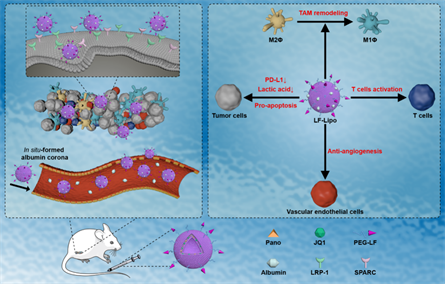
乳铁蛋白修饰、白蛋白原位吸附的靶向脂质体递药体系及用于结直肠癌联合治疗的示意图
原文链接:https://doi.org/10.1016/j.apsb.2021.09.022
供稿部门:黄永焯课题组

